
AUTEUR DE L’ARTICLE
Docteur vétérinaire Graham ZOLLER – Dip ECVZ
Présentation du cas
Un furet âgé de 4,5 ans, de sexe femelle stérilisée chimiquement est présenté pour abattement, diarrhée et vomissements d’apparition aiguë la veille de la présentation. Depuis elle demeure anorexique, ne boit pas et produit peu de selles. Habituellement, la furette vit seule en liberté dans un appartement et reçoit une alimentation constituée de croquettes pour furets. Ses antécédents médicaux se limitent à une malasseziose cutanée avec prurit généralisé. Elle est correctement vaccinée contre la maladie de Carré.
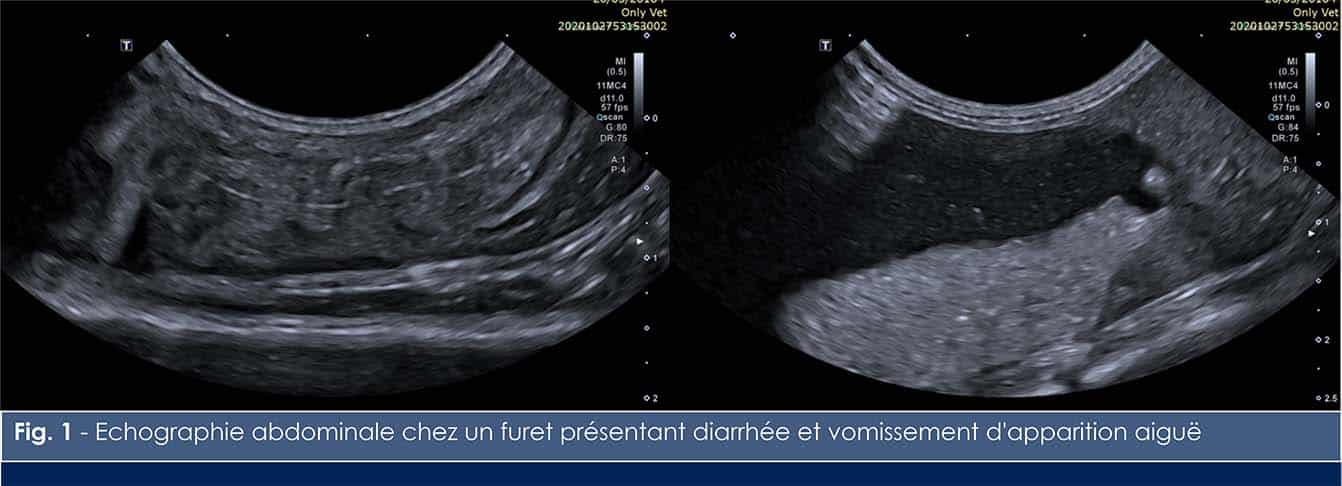
L’examen clinique révèle un animal en bon état de chair, normotherme, vif et normohydraté. La palpation abdominale craniale est inconfortable. Un bilan biochimique est réalisé et ne révèle aucune anomalie significative. Une échographie abdominale est réalisée (Figure 1)
Sommaire
- Quel est votre diagnostic différentiel en cas de vomissements chez un furet ?
- A l’aide des données anamnestico-cliniques et des résultats des examens complémentaires, quel est votre diagnostic ?
- Quelle est votre approche thérapeutique immédiate ?
- Quel est votre pronostic et quels sont vos recommandations pour ce patient ?
Quel est votre diagnostic différentiel en cas de vomissements chez un furet ?
Les causes de vomissements chez le furet sont multiples et incluent des désordres métaboliques (maladies hépatobiliaires, insuffisance rénale, diabète), néoplasiques (lymphome digestif, insulinome), nutritionnels (nourriture avariée, allergie alimentaire), inflammatoire (maladie inflammatoire chronique intestinale lymphocytaire voire éosinophilique, ulcère gastrique, pancréatite), traumatique (corps étrangers), toxique (ibuprofène, chocolat, pyréthrinoïdes, acétaminophène) et infectieux d’origine bactérienne (digestive : hélicobactériose, campylobactériose, salmonellose ou extradigestive : pyomètre, pyélonéphrite), virale (coronavirus entérique du furet, maladie de Carré, maladie aléoutienne) ou parasitaire (giardiose, coccidiose, cryptosporidiose).
A l’aide des données anemnestico-cliniques et des résultats des examens complémentaires, quel est votre diagnostic ?
L’échographie abdominale révèle (1) un iléus gastrique caractérisé par une distension liquidienne importante de l’estomac (Figure 1) et (2) un corps étranger linéaire échogène d’environ 3 cm tendu au sein de la lumière d’une anse jéjunale présentant des plicatures (Figure 1) . L’épaisseur et la paroi des couches échographiques est dans les limites de la normale sans évidence de signe d’hépatite, de pancréatite ou de péritonite. Ces images permettent de diagnostiquer une obstruction digestive secondaire à l’ingestion d’un corps étranger linéaire.
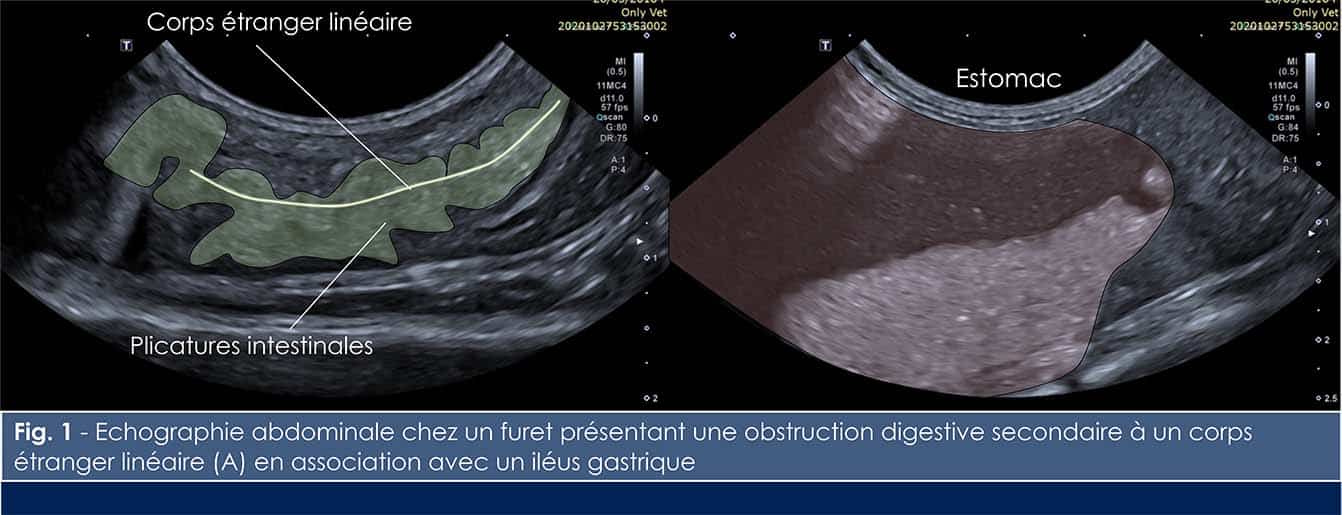
L’ingestion de corps étrangers est fréquente chez les furets. Les jeunes, de nature curieuse, ont tendance à mâchonner des objets de consistance caoutchouteuse ce qui les prédispose à ce type de problème. Chez les furets plus âgés, l’ingestion excessive de poils associée à l’existence de problèmes dermatologiques (maladie surrénalienne, prurit) est également une cause d’obstruction digestive associée au développement de trichobézoard. Enfin, la forte prévalence des maladies gastro-intestinales chroniques chez cette espèce (infiltration lymphoplasmocytaire ou éosinophilique, lymphome, ulcères) pourrait être un facteur de pica.
Les signes cliniques associés à l’ingestion de corps étrangers incluent des vomissements (60% des cas), des frottements de la bouche avec les pattes (signe de nausée, dans 52% des cas), de la diarrhée (56% des cas) et de l’anorexie (52% des cas). En cas de suspicion clinique, la radiographie est diagnostique dans environ 30 à 90% des cas selon les études.1,2 Alternativement, l’échographie représente la méthode de choix pour le diagnostic de cette affection.
Quelle est votre approche thérapeutique immédiate ?
La présence d’un corps étranger linéaire associé à des signes d’obstruction digestive justifie la réalisation d’une entéro/entérectomie en urgence. En effet, le pronostic est d’autant plus sombre que l’intervention est repoussée car le risque de complication augmente avec le temps (perforation, nécrose, péritonite, translocation bactérienne, état de choc). Une stabilisation médicale est réalisée en prévenant la douleur (morphine 0,1 mg/kg SC), les translocations bactériennes (amoxicilline clavulanate 15 mg/kg IV), et le choc cardiovasculaire (fluidothérapie (NaCl 0,9% 10 ml/kg/h IV) en association avec des mesures de soutien de la température).
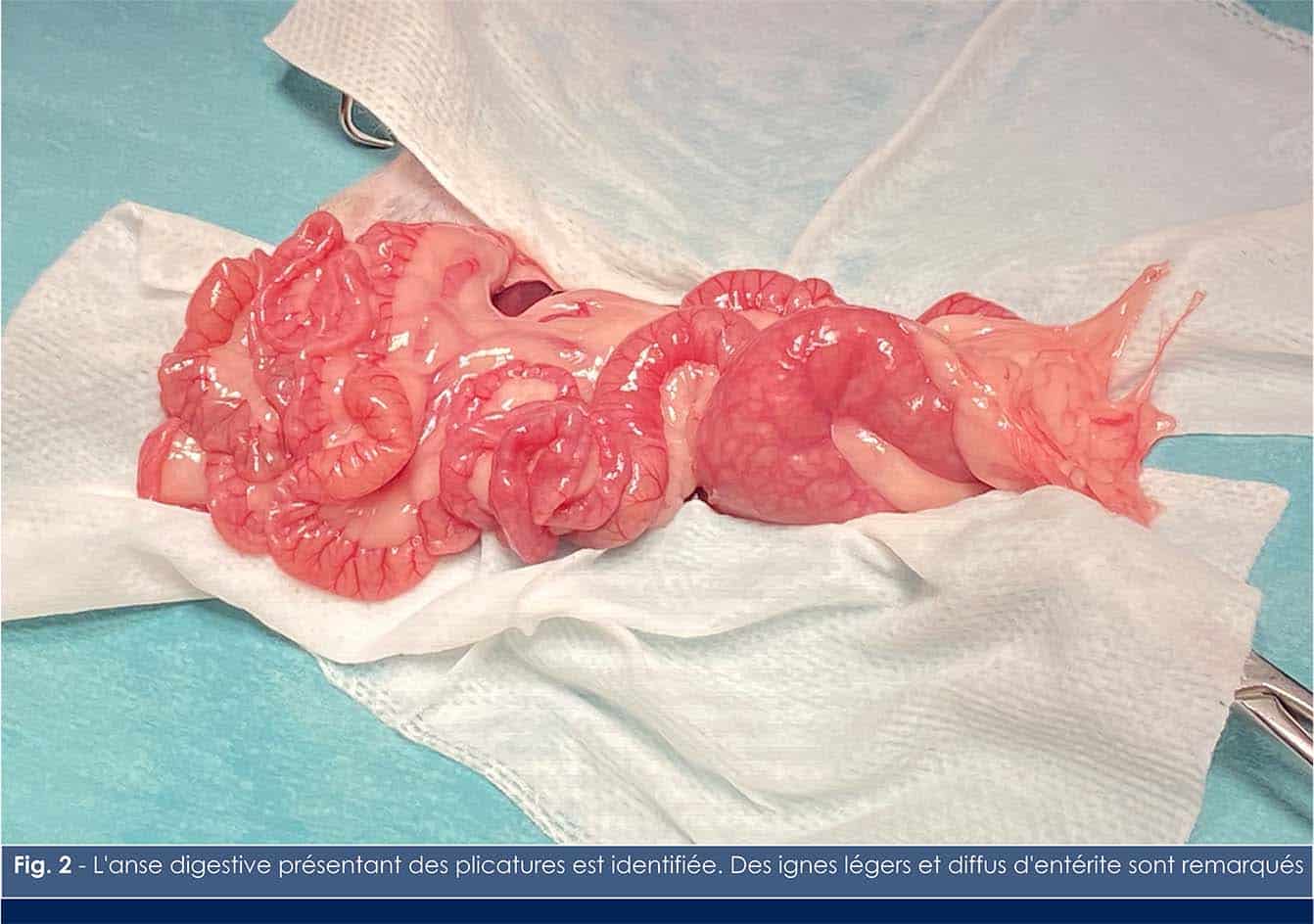
La technique opératoire pour une entérotomie chez le furet est en principe similaire à celle employée chez les autres carnivores. Toutefois, quelques spécificités peuvent s’appliquer compte-tenu de la fragilité et de la petite taille des tissus. Une laparotomie xyphopubienne est réalisée et la cavité abdominale est inspectée. L’ensemble du système digestif est évalué. Dans notre cas, des signes légers et diffus d’entérite sont observés et le segment jéjunal présentant des plicatures est identifié (Figure 2). Une manipulation délicate des tissus est nécessaire (par exemple avec une pince de DeBakey) pour préserver l’apport sanguin et une irrigation régulière avec un liquide stérile tiède est indispensable. L’anse digestive d’intérêt est isolée avec des compresses humides.
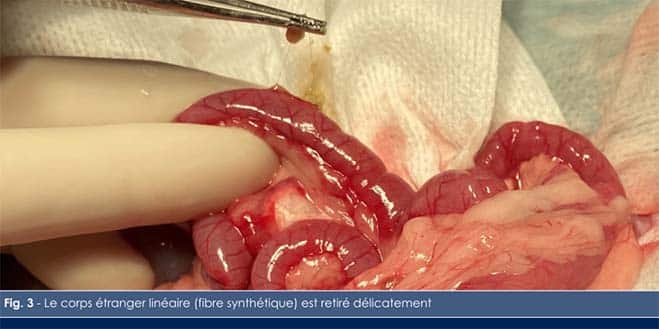
Des barrettes épingles peuvent être utilisées comme alternative aux pinces de doyen pour maintenir le chyle intestinal à distance du site d’entérotomie chez les plus petits patients.3 Une incision longitudinale est réalisée au bord anti-mésentérique et permet le retrait d’un corps étranger linéaire de type fibre synthétique (Figure 3). Les corps étrangers linéaires se retrouvent souvent ancrés en amont de l’obstruction (par exemple au pylore) tandis que le péristaltisme intestinal essaye de faire progresser l’extrémité libre. Se faisant, les intestins se replient en « accordéon » et tirent le corps étranger linéaire contre le bord mésentérique ce qui est à l’origine d’un cisaillement de la paroi. Un retrait délicat est nécessaire pour ne pas aggraver la situation et la recherche minutieuse d’une perforation digestive est de rigueur.
Le site d’entérotomie est refermé à l’aide d’un surjet simple apposant avec un fil résorbable 5-0 monté sur une aiguille ronde. Dans certains cas, lorsque la lumière est de petit diamètre, il est possible de fermer le site d’entérotomie de façon transverse, en réalisant un surjet entre les marges orales et aborales de l’incision (Figure 4). Il est important que la suture implique la sous-muqueuse qui est la couche la plus résistante. Cette couche peut être difficile à visualiser chez les petits carnivores. Bien qu’il soit idéal que la suture ne pénètre pas la lumière digestive, cela pose rarement un problème. Aussi, lorsque la sous-muqueuse est difficile à identifier, il est préférable de réaliser une suture perforante. L’étanchéité de la suture peut être vérifiée en utilisant une aiguille de 31 G montée sur une seringue de 0,3 mL.
Il est à signaler que les fuites digestives sont initialement limitées par les sutures et les caillots de fibrine. Aussi, il est important de ne pas nettoyer les caillots qui se forment sur le site d’entérotomie : ils sont importants pour le bon déroulement post-opératoire. L’abdomen est rincé abondamment (100-200 mL/kg) avec du liquide physiologique tiède. L’incision intestinale est omentalisée et l’abdomen est refermé plan par plan.
Quel est votre pronostic et quels sont les soins à moyen terme ?
Globalement, le pronostic est relativement bon avec un taux de survie post-opératoire immédiat de 86%.1 Les complications principales d’une entérotomie chez le furet incluent une sténose intestinale, une déhiscence des sutures, une pancréatite iatrogène ou une fuite de contenu digestif et une péritonite. Moins fréquemment des adhérences ou des étranglements peuvent se former et un iléus paralytique peut se produire. Suite à l’intervention, la fluidothérapie est poursuivie jusqu’à reprise de l’appétit (2 mL/kg/h IV). Le soluté est complémenté avec de la lidocaïne (1 mg/kg/h) pour son effet potentiellement bénéfique sur la reprise du fonctionnement gastro-intestinal et avec de la kétamine pour compléter l’analgésie. Un sevrage analgésique est progressivement réalisé (morphine puis buprénorphine) sur 48 heures. Des anti-acides sont également administrés (pantoprazole 1 mg/kg IV q12h) en association avec des pansements digestifs (sucralfate 100 mg/kg PO q8-12h). Enfin l’antibiothérapie est poursuivie (association d’amoxicilline clavulanate 15 mg/kg PO q12h et de métronidazole 20 mg/kg PO q12h).
Une réalimentation rapide est importante pour la cicatrisation de la paroi intestinale car ce sont les nutriments présents dans la lumière digestive qui apportent un apport nutritif aux entérocytes et favorisent la perfusion sanguine intestinale. Celle-ci est instaurée dans les 8-12 heures suivant l’intervention chirurgicale et est réalisée avec des aliments liquides semi-élémentaires (p.ex. Carnivore care). La reprise de l’alimentation solide doit quant à elle être progressive pour obtenir un retour à une alimentation normale 7 jours post-opératoires. Les furets sortent en moyenne après 48 heures de l’hôpital.
Enfin, une évaluation critique de l’environnement est nécessaire pour retirer tout corps étranger potentiel (objet en caoutchouc, silicone, mousse, éponge, gomme, fibre synthétique et autres fils). Dans notre cas, un tunnel déchiré et rembourré de fibres de polyester et a été déterminé être à l’origine de l’ingestion du corps étranger linéaire. Idéalement, les furets devraient être surveillés lors de leur sortie.
Références
- Mullen SH, Fox J, Marini RP. Ferrets: Gastrointestinal Foreign Bodies. Clinical Veterinary Advisor: Birds and Exotic Pets. 2012:454-456.
- Sladky K, Miwa Y. Small Mammals: Common Surgical Procedures of Rodents, Ferrets, Hedgehogs, and Sugar Gliders. Veterinary Clinics of North America Exotic Animal Practice. 2016;19:205-243.
- Di Girolamo N, Selleri P. Medical and Surgical Emergencies in Ferrets. Veterinary Clinics of North America: Exotic Animal Practice. 2016;19:431-464.



